11月19日,我院李博文教授團(tuán)隊(duì)在國際知名期刊《美國化學(xué)會-納米(ACS Nano)》(IF=16.0,中科院一區(qū)TOP),發(fā)表了題為《二硒鍵自組裝前藥遞送系統(tǒng)用于增強(qiáng)骨關(guān)節(jié)炎治療(A Diselenide-Linkage Self-Assembled Nano-Prodrug for Enhanced Osteoarthritis Treatment)》的原創(chuàng)性研究性論文。香港中文大學(xué)(深圳)與我校聯(lián)合培養(yǎng)博士后李志遙博士為文章第一作者,李博文教授為本論文通訊作者,香港中文大學(xué)(深圳)/龍崗中心醫(yī)院主任陳榮琳及山東省立醫(yī)院喬立博士為本論文共同通訊作者,我校為第一完成單位。
骨關(guān)節(jié)炎(Osteoarthritis,OA)是一種高度復(fù)雜的退行性關(guān)節(jié)疾病,長期處于炎癥反復(fù)、氧化應(yīng)激加劇以及軟骨持續(xù)退化等多重病理因素交織的微環(huán)境中。傳統(tǒng)臨床策略主要依賴鎮(zhèn)痛藥物、關(guān)節(jié)腔注射和物理康復(fù)等單一對癥手段,僅能緩解癥狀,卻難以有效干預(yù)疾病的多通路進(jìn)展。鑒于其多因素驅(qū)動的病理特征,要實(shí)現(xiàn)真正的疾病修飾和進(jìn)程阻斷,亟須整合抗炎、抗氧化、軟骨保護(hù)與再生促進(jìn)等多機(jī)制的多模式協(xié)同治療策略,實(shí)現(xiàn)對復(fù)雜關(guān)節(jié)微環(huán)境的系統(tǒng)性調(diào)控,從而實(shí)現(xiàn)其高效精準(zhǔn)安全的治療。
基于上述臨床問題,李博文教授團(tuán)隊(duì)構(gòu)建了原位激活型多組分自組裝前藥遞送系統(tǒng),以“分子自組裝+多藥協(xié)同”為核心策略,巧妙利用OA內(nèi)源性響應(yīng)激活釋放機(jī)制,實(shí)現(xiàn)了針對OA的多模式、精準(zhǔn)且高效的多藥協(xié)同治療。
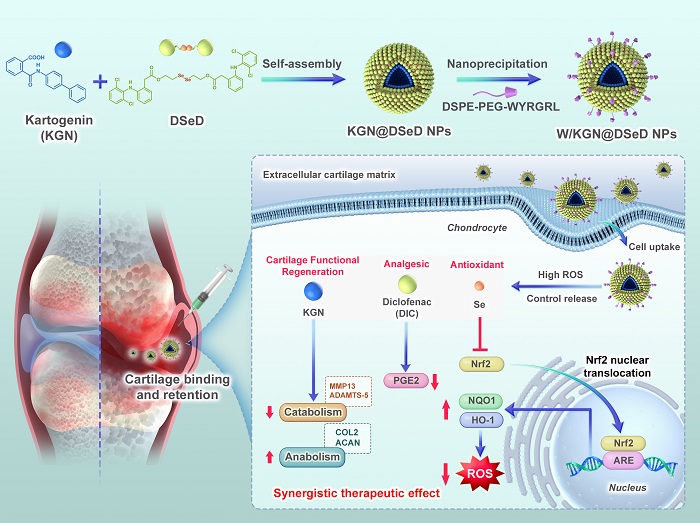
該系統(tǒng)以二硒鍵將雙氯芬酸(Diclofenac)與軟骨再生促進(jìn)劑卡托吉寧(Kartogenin) 連接,并通過軟骨靶向肽 (WYRGRL) 的修飾實(shí)現(xiàn)高效靶向遞送。在骨關(guān)節(jié)炎特異性微環(huán)境刺激下,自組裝前藥遞送系統(tǒng)能夠響應(yīng)性地釋放雙氯芬酸、卡托吉寧和硒元素(Se)。在多模式治療機(jī)制中,硒元素與雙氯芬酸通過激活Nrf2信號通路,協(xié)同提升軟骨細(xì)胞的抗氧化防御能力,顯著緩解炎癥反應(yīng)與疼痛;而卡托吉寧則進(jìn)一步促進(jìn)軟骨修復(fù)與關(guān)節(jié)微環(huán)境重塑,從而形成抗炎—抗氧化—軟骨再生的多通路協(xié)同效應(yīng)。OA小鼠模型中,所構(gòu)建的前藥遞送系具有顯著的軟骨靶向性、優(yōu)良的關(guān)節(jié)腔滯留時(shí)間、有效的OA病理微環(huán)境改善能力,以及整體安全高效的治療表現(xiàn)。該研究利用二硒鍵驅(qū)動的自組裝前藥創(chuàng)新策略,實(shí)現(xiàn)了對骨關(guān)節(jié)炎微環(huán)境的精準(zhǔn)調(diào)控,為多模式骨關(guān)節(jié)炎治療提供了具有廣闊應(yīng)用前景的全新方向。
研究得到我校以及深圳相關(guān)項(xiàng)目和基金的資助。(藥學(xué)科學(xué)學(xué)院)

 秉承“修身至善、博學(xué)悟真、中西兼容、知行并進(jìn)”育人理念,培養(yǎng)“懂醫(yī)精藥、善研善成”高層次藥學(xué)專業(yè)人才。
秉承“修身至善、博學(xué)悟真、中西兼容、知行并進(jìn)”育人理念,培養(yǎng)“懂醫(yī)精藥、善研善成”高層次藥學(xué)專業(yè)人才。 秉承“修身至善、博學(xué)悟真、中西兼容、知行并進(jìn)”育人理念,培養(yǎng)“懂醫(yī)精藥、善研善成”高層次藥學(xué)專業(yè)人才。
秉承“修身至善、博學(xué)悟真、中西兼容、知行并進(jìn)”育人理念,培養(yǎng)“懂醫(yī)精藥、善研善成”高層次藥學(xué)專業(yè)人才。 秉承“修身至善、博學(xué)悟真、中西兼容、知行并進(jìn)”育人理念,培養(yǎng)“懂醫(yī)精藥、善研善成”高層次藥學(xué)專業(yè)人才。
秉承“修身至善、博學(xué)悟真、中西兼容、知行并進(jìn)”育人理念,培養(yǎng)“懂醫(yī)精藥、善研善成”高層次藥學(xué)專業(yè)人才。 秉承“修身至善、博學(xué)悟真、中西兼容、知行并進(jìn)”育人理念,培養(yǎng)“懂醫(yī)精藥、善研善成”高層次藥學(xué)專業(yè)人才。
秉承“修身至善、博學(xué)悟真、中西兼容、知行并進(jìn)”育人理念,培養(yǎng)“懂醫(yī)精藥、善研善成”高層次藥學(xué)專業(yè)人才。 秉承“修身至善、博學(xué)悟真、中西兼容、知行并進(jìn)”育人理念,培養(yǎng)“懂醫(yī)精藥、善研善成”高層次藥學(xué)專業(yè)人才。
秉承“修身至善、博學(xué)悟真、中西兼容、知行并進(jìn)”育人理念,培養(yǎng)“懂醫(yī)精藥、善研善成”高層次藥學(xué)專業(yè)人才。








